Современные технологии в диагностике и лечении гидронефроза
- Информация о материале
- Опубликовано: 03 июня 2014
После 9-го Всероссийского съезда урологов, посвященного проблеме гидронефроза, прошло 10 лет. За прошедшие годы структура обследования и лечения этой категории больных претерпела существенные изменения. Это связано с широким использованием высокотехнологичных лучевых, эндоскопических и патоморфологических исследований, отличительной чертой которых стала оценка функционального состояния почки и верхних мочевых путей. Исследования мало или вовсе неинвазивны, высоко информативны, чувствительны и специфичны, практически не имеют осложнений. Благодаря их применению упростилась и стала возможной ранняя диагностика заболевания. Значительный прорыв в обследовании и лечении больных стенозом лоханочно-мочеточникового сегмента (ЛМС), гидронефрозом стал возможен благодаря фундаментальным морфологическим и клиническим исследованиям, убедительно свидетельствующим о крайне высокой регенераторной способности почечной ткани при длительно существующей обструкции верхних мочевых путей (Ю.М. Постолов, 1992; А.Г. Пугачев, 1994; Д.С. Саркисов, М.А. Пальцев, Н.К. Хитров, 1997; Ю.В. Кудрявцев, и соавт., 1997; Ю.А. Пытель, 1997; О.В. Теодорович и соавт., 2000; Ю.Г. Аляев, М.А. Пальцев, В.А. Григорян, А.И. Лысенко и соавт., 2007; P. Yohannes, P. Rotariu, 2002). Во многом благодаря использованию современных морфо-функциональных методик открываются перспективы создания надежных прогностических критериев состояния почечной паренхимы и верхних мочевых путей у больных гидронефрозом. Это позволяет продолжить исследования для выработки научно-обоснованных подходов, как к органосохраняющим, так и органоуносящим операциям (Григорян В.А., Лысенко А.И. и соавт., 2007).
Столь разительные перемены в диагностике гидронефроза не могли не отразиться на особенностях лечения больных. Накапливается опыт применения малоинвазивных хирургических пособий, совершенствуются оперативная техника, шовный материал и методы дренирования верхних мочевых путей. Проводятся лапаро- и ретроперитонеоскопические коррекции заболевания с оптимистичными отдаленными результатами (В.Н. Степанов, 2000; О.В. Теодорович и соавт., 2003; А.Г. Мартов и соавт, 2002; М.И. Коган и соавт., 2005; P. Van Cangh, 2005;).
И, тем не менее, на фоне стремительного развития и клинического внедрения современных высокотехнологичных методов исследования, проблема гидронефроза ни в коей мере не потеряла присущую ей остроту. Число больных не становится меньше (а за счет раннего выявления – возрастает), заболевание по-прежнему часто протекает бессимптомно, приводя к выраженным структурно-функциональным изменениям почечной паренхимы и верхних мочевых путей, когда органосохраняющая операция уже неэффективна. В отличие от начальных стадий заболевания, когда органосохраняющий подход является общепринятым, при «старом» (С.П. Федоров, 1923) гидронефрозе, до сих пор, как правило, выполняется нефрэктомия. Частота органоуносящих пособий достигает 37% (О.И. Братчикова и соавт.,1997; З.А. Павловская, 1999). Столь высокий процент нефрэктомий с последующей инвалидизацией больных во многом обусловлен отсутствием единого подхода к оценке структурно-функционального состояния почки и верхних мочевых путей при выраженной дилатации чашечно-лоханочной системы (ЧЛС) и, что очень важно, критериев обратимости состоявшихся изменений (Ю.А. Пытель, 1997; О.Б Лоран и соавт., 1997; Н.А. Лопаткин и Э.К. Яненко, 1997; Ю.Г. Аляев и соавт., 2002).
Таким образом, несмотря на активное клиническое применение, сложность, многочисленность и недостаточная изученность современных высокотехнологичных методов исследования, используемых в диагностике гидронефроза, несомненно, требуют их обобщения и сравнительного анализа с последующим логически обоснованным выбором и определенной последовательностью использования. Значительный удельный вес гидронефроза среди прочих урологических заболеваний и неоднозначность результатов лечения больных этим недугом, требует систематизации знаний и опыта, накопленного за последние годы. Это позволит оценить характер структурно-функциональных изменений в почке и верхних мочевых путях на фоне обструкции с учетом современных диагностических возможностей, а также - обосновать выбор того или иного вида хирургического и (или) консервативного лечения.
Научная новизна
Проведено фундаментальное клинико-морфологическое исследование структурно-функционального состояния почек и верхних мочевых путей при стенозе ЛМС, гидронефрозе с применением современных высокотехнологичных клинических (мультиспиральная компьютерная томография (МСКТ) с «виртуальной уретеропиелоскопией», магнитно-резонансная томография, эходопплерография, эндолюминальное УЗИ, статическая нефросцинтиграфия с интегральным захватом радиофармпрепарата, оптическая уретеропиелоскопия) и патоморфологических (морфометрия, иммуноморфологический анализ) методик.
С позиций доказательной медицины с применением современных высокотехнологичных клинических и морфо-функциональных методов исследований произведена оценка обратимости изменений почечной паренхимы и верхних мочевых путей при разных стадиях гидронефроза.
Впервые при помощи иммуноморфологического исследования почечной паренхимы у больных различными стадиями стеноза ЛМС, гидронефроза выявлены характерные особенности экспрессии антигенов-компонентов стромы (виментин) и сосудистого русла ткани почек (α-гладкомышечный актин, CD34), а также факторов регуляции ангиогенеза (VEGF).
Разработана модель интраоперационного ориентирования с математических позиций при реконструкции верхних мочевых путей у больных стенозом ЛМС, гидронефрозом.
Клиническими и морфологическими методами исследования доказано, что терминальная А стадия гидронефроза обратима, и этой категории больных показано выполнение органосохраняющих реконструктивных операций.
На основании результатов клинических и морфологических исследований, свидетельствующих о высоких регенеративных возможностях почечной паренхимы, предложена новая комплексная методика подготовки больных поздними стадиями гидронефроза к реконструктивным оперативным пособиям, включающая использование стимуляторов стволовых клеток костного мозга.
Практическая значимость работы
Разработаны показания, рациональный объем и последовательность применения современных высокотехнологичных методов исследования у больных стенозом ЛМС, гидронефрозом. Это привело к сокращению инвазивных лучевых и эндоскопических методов исследования (цистоскопия, ретроградная, антеградная уретеропиелография, оптическая уретеропиелоскопия и др.) на 34,8%, уменьшению частоты инфицирования мочевых путей и ятрогенных осложнений в виде острого простатита, пиелонефрита и травмы мочевых путей в 2,06 раза; практически полному отказу от почечной ангиографии, количество осложнений при которой составило более 7%, а смертность - 0,04%; уменьшению койко-дня в 1,48 раза.
Разработана и внедрена в практику методика обследования и подготовки больных поздними стадиями гидронефроза к реконструктивным операциям; выработаны прогностические клинические, иммуноморфологические и морфометрические критерии степени изменений почечной паренхимы и возможности их обратимости, что способствовало снижению органоуносящих пособий у этой категории больных до 32%.
Разработана и внедрена в практику модель интраоперационного ориентирования с математических позиций у больных стенозом ЛМС, гидронефрозом при различных типах и состояниях ЧЛС, что позволяет обоснованно с учетом конкретной топографо-анатомической ситуации осуществлять реконструкцию верхних мочевых путей.
Индивидуально обоснованное применение современных высокотехнологичных методов исследования (мультиспиральная компьютерная томография (МСКТ), магнитно-резонансная томография (МРТ), «виртуальная эндоскопия», статическая нефросцинтиграфия с интегральным захватом РФП, эходопплерография, оптическая уретеропиелоскопия, морфометрия и иммуноморфологический анализ) и лечения (микрохирургическая техника, современный шовный материал, внутреннее дренирование верхних мочевых путей, клеточная терапия в поздних стадиях) у больных стенозом ЛМС, гидронефрозом позволило снизить количество осложнений с 8 до 1,1% и увеличить эффективность открытых реконструктивных операций с 82,3 до 92,9%.
Внедрение результатов работы
Разработанные современные подходы к обследованию и лечению больных различными стадиями стеноза ЛМС, гидронефроза с учетом клинико-морфологических особенностей течения заболевания внедрены в повседневную практику урологической клиники и кафедры патологической анатомии Московской медицинской академии им. И.М. Сеченова, используются при обучении студентов, ординаторов и аспирантов.
Разработанные принципы обследования и лечения больных различными стадиями стеноза ЛМС, гидронефроза планируется внедрить в клиническую практику урологических отделений городских больниц и профильных федеральных центров здравоохранения. Материалы диссертации использованы при написании учебника «Урология» для студентов медицинских вузов, монографии «Современные технологии в диагностике и лечении мочекаменной болезни», национального руководства по нефрологии.
Объем и методы исследований
Работа выполнена на базе урологической клиники (дир.- член корр. РАМН, профессор Аляев Ю.Г.), кафедры патологической анатомии (зав. кафедрой – академик РАН и РАМН, профессор Пальцев М.А.) ММА им. И.М. Сеченова и межклинической лаборатории молекулярных методов диагностики ММА им. И.М. Сеченова (зав. - Пальцева Е.М.).
Исследование основано на анализе результатов обследования и лечения 765 больных стенозом ЛМС, гидронефрозом, находившихся в урологической клинике ММА им. И.М. Сеченова с 1980 по 2007 гг. Исключение - 2 больных уретероцеле и уретерогидронефрозом верхней половины удвоенной почки, наряду с оперативным лечением, получавших стимулятор стволовых клеток костного мозга ввиду выраженных структурно-функциональных изменений почечной паренхимы.
При стадировании заболевания мы руководствовались классификацией, разработанной академиком РАМН Н.А. Лопаткиным в 1969 и дополненной в 1978 годах. Классификация предусматривает выделение 3-х основных стадий:
1 стадия (начальная) - расширение только лоханки (пиелоэктазия) с незначительным нарушением функции почки; 2 стадия (ранняя) - расширение не только лоханки, но и чашечек (гидрокаликоз), уменьшение толщины паренхимы и значительное нарушение ее функции; 3 стадия (терминальная) А и Б (в зависимости от степени нарушения канальцевой функции и величины АД) - резкая атрофия паренхимы почки, превращение ее в тонкостенный мешок.
У 89 больных установлена 1-ая (начальная) стадия заболевания. Период развернутых клинических проявлений (ранняя стадия гидронефроза) выявлен у 601 пациента. Терминальные А и Б стадии заболевания выявлены у 75 пациентов.
Всем больным проводили комплексное обследование, предусматривающее изучение жалоб, сбор анамнеза, физикальные и лабораторные исследования, а также индивидуально обоснованные современные высокотехнологичные клинические и патогистологические методы исследования (табл. 1,2).
Таблица 1. Клинические методы исследования (n=765)
|
Вид исследования |
Абс |
% |
|
Клинический анализ крови |
765 |
100 |
|
Общий анализ мочи |
765 |
100 |
|
Анализ мочи по Нечипоренко |
765 |
100 |
|
Проба по Зимницкому |
427 |
56 |
|
Проба Реберга |
68 |
8,9 |
|
Бактериологическое исследование мочи |
285 |
37,3 |
|
Экскреторная урография |
668 |
87,3 |
|
УЗИ почек |
759 |
99,2 |
|
Эндолюминальное УЗИ верхних мочевых путей |
28 |
- |
|
Фармакоультразвуковое исследование почек |
382 |
49,9 |
|
Эходопплерография сосудов почек |
207 |
- |
|
Интраоперационная эходопплерография сосудов почек |
20 |
- |
|
Радионуклидные методы |
604 |
79 |
|
МСКТ почек и верхних мочевых путей |
171 |
- |
|
Виртуальная эндоскопия верхних мочевых путей |
67 |
- |
|
СКТ почек |
18 |
- |
|
МР-урография |
36 |
- |
|
Оптическая уретеропиелоскопия |
5 |
- |
|
Комплексное сосудистое исследование почек |
240 |
- |
|
Антеградная пиелоуретерография |
243 |
31,8 |
|
Ретроградная уретеропиелография |
96 |
12,5 |
За последнее время значительные изменения произошли в подходах к клиническому обследованию больных стенозом ЛМС, гидронефрозом. Эндолюминальное ультразвуковое исследование верхних мочевых путей, эходопплерография сосудов почек (в том числе интраоперационная), мультиспиральная компьютерная томография (МСКТ) с виртуальной эндоскопией, магнитно-резонансная урография (МР-урография), оптическая уретеропиелоскопия стали применяться в клинике урологии ММА им. И.М. Сеченова в конце 90-х — 2000-х годах. Востребованность других методов исследования, таких как ретроградная и антеградная уретеропиелография, спиральная компьютерная томография (СКТ) и ангиография, значительно снизилась.
Таблица 2. Патоморфологические методы исследования почечной паренхимы и верхних мочевых путей (n=612)
|
Методы исследования |
К-во оперированных больных |
К-во исследований |
|
Гистологический * |
612 |
601 |
|
Морфометрический * |
115 |
115 |
|
Иммуноморфологический ** |
34 |
168 |
*исследованы ткань почки и верхних мочевых путей
** исследована ткань почки
Результаты использованных клинических, лучевых, морфологических и лабораторных исследований позволяли получить необходимую информацию о состоянии почек и мочевых путей. Информация, полученная при использовании клинических методов исследования, дополнялась данными интраоперационной оценки почки и верхних мочевых путей и результатами патоморфологических исследований. Аналогичные индивидуально обоснованные клинические методы исследования проведены у 360 больных после реконструктивных операций.
Для определения степени выраженности морфологических изменений и функциональной состоятельности почки при гидронефрозе использовали традиционные патогистологические критерии, характеризующие степень изменений почечной паренхимы на фоне обструктивной уропатии.
На основании результатов гистологического исследования было выделено 3 степени морфологических изменений почечной паренхимы.
1. Дистрофические изменения канальцев, уплощение нефротелия; очаговый, а в ряде наблюдений – диффузный нефрогидроз. Изменения соответствовали ранней стадии гидронефроза.
2. Нефрогидроз с явлениями атрофии канальцев. Очаговый нефросклероз. Количество сохранных клубочков во всех наблюдениях превалировало либо равнялось количеству гиалинизированных. В ряде биоптатов обнаружены признаки хронического воспаления. Большинство нефронов сохранно. Изменения соответствовали терминальной А стадии гидронефроза.
3. Грубые необратимые изменения почечной паренхимы: диффузная атрофия почечной паренхимы, выраженный интерстициальный фиброз. В большинстве клубочков наблюдался коллапс петель, гломерулогиалиноз. Некоторые атрофичные канальца были резко растянуты, кистозно расширены и напоминали фолликулы щитовидной железы (картина «щитовидной почки»). Изменения соответствовали терминальной Б стадии гидронефроза.
Морфометрический анализ структурного состояния верхних мочевых путей включал расчет соединительнотканно-мышечного коэффициента (СМК) (отношение объема соединительной ткани к объему гладкой мускулатуры) для каждого изображения и среднего значения для микропрепарата. Аналогично рассчитывали плотность упаковки почечных клубочков (ПУК) (отношение общей площади клубочков к единице площади микропрепарата; измеряется в долях целого).
Иммуноморфологическое исследование проводили на 35 биоптатах почечной паренхимы, полученных у 26 больных. В группу контроля вошли 8 почечных биоптатов без признаков нефрогидроза.
Иммуноморфологическому исследованию предшествовало морфологическое исследование биоптатов, окрашенных гематоксилином-эозином, пикрофуксином по ван Гизон, и обработанных по методике PAS-реакция. Кроме того, проводили оценку сохранности гистиоархитектоники органа в пределах площади среза. Грубые нарушения гистиоархитектоники: отсутствие деления на корковое и мозговое вещество ткани почки, тотальный склероз интерстиция и тотальный гломерулосклероз, отсутствие признаков функционирующей паренхимы расценивали как убедительное свидетельство необратимых (терминальных) изменений. В качестве первичных антител использовали моноклональные антитела к VEGF (DAKO, Дания, клон VG1, в концентрации 1:200), виментину (DAKO, Дания, клон VIM3B4, RTU), СD34 (DAKO, Дания, клон QBEnd 10, RTU), aSMA (DAKO, Дания, клон 1F4, RTU). Для выявления продуктов иммуногистохимической реакции использовали систему визуализации Super Sensetive Polymer-HRP Detection System (BioGenex, США), в качестве хромогена - забуференный раствор диаминобензидина.
Дренирование верхних мочевых путей у больных поздними (терминальная А и Б) стадиями заболевания для определения степени обратимости возникших изменений, а также подготовки почки к органосохраняющей операции и оценки ее прогностической перспективности значительно чаще применять с конца 90-х годов (у 16,2% больных гидронефрозом, которым планировалось операция). Дренирование верхних мочевых путей у больных поздними стадиями гидронефроза (терминальная А и Б) проведено в 41 наблюдении – в 26-ти - пункционная нефростомия; 15-ти – стентирование.
Из 765 больных гидронефрозом хирургическому лечению было подвергнуто 612 (80%) (табл. 3). У 154 из 765 (20%) больных оперативное пособие было признано нецелесообразным. Из них у 54 - в связи с положительным эффектом консервативной терапии.
Таблица 3. Распределение больных стенозом ЛМС, гидронефрозом в зависимости от характера операции (n = 612)
|
Резекция лоханки и верхней трети мочеточника, уретеропиелостомия |
272 |
|
Резекция лоханки и верхней трети мочеточника, уретеропиелостомия, резекция почки, резекция нижнесегментарного сосуда |
125 |
|
Резекция лоханки и верхней трети мочеточника, уретеропиелостомия, удаление камней |
76 |
|
Резекция лоханки и верхней трети мочеточника, уретеропиелостомия, резекция почки, удаление камней |
28 |
|
Резекция подковообразной почки, резекция лоханки и верхней трети мочеточника, уретеропиелостомия, удаление камней |
8 |
|
Резекция лоханки и верхней трети мочеточника, антевазальная уретеропиелостомия |
1 |
|
Резекция лоханки и верхней трети мочеточника, уретеропиелостомия, вазопликация |
35 |
|
Резекция лоханки и верхней трети мочеточника, уретеропиелостомия, декапсуляция почки (при остром пиелонефрите) |
3 |
|
Резекция лоханки и верхней трети мочеточника, уретеропиелостомия, калико-каликостомия |
3 |
|
Нефрэктомия |
48 |
|
Геминефрэктомия при подковообразной почке |
2 |
|
Резекция правой яичниковой вены |
2 |
|
Уретеролизис |
3 |
|
Резекция нижнесегментарных сосудов |
1 |
|
Чрескожные рентгенэндоскопические операции |
5 |
|
Итого |
612 |
У 4-х пациентов выполняли малоинвазивные пособия по поводу стеноза уретеропиелоанастомоза.
Таблица 4. Распределение больных стенозом ЛМС, гидронефрозом и стенозом уретеропиелоанастомоза в зависимости от характера эндоскопической операции (n = 9)
|
Вид операции |
Количество больных |
|
Перкутанная инвагинационная эндопиелотомия ввиду стеноза ЛМС |
4 |
|
Перкутанная инвагинационная эндопиелотомия ввиду стеноза уретеропиелоанастомоза |
2 |
|
Трансуретральная эндопиелотомия ввиду стеноза уретеропиелоанастомоза |
1 |
|
Перкутанное бужирование уретеропиелоанастомоза |
1 |
|
Перкутанное бужирование стеноза ЛМС |
1 |
|
Всего |
9 |
Таким образом, 612 больным произведено в общей сложности 616 операций. Из них открытых реконструктивных пособий на верхних мочевых путях, почечной паренхиме и сосудах – 559 (90,7), малоинвазивных рентгенэндоскопических – 9 (1,5%) (табл. 4). В 48 (7,8%) наблюдениях выполнена нефрэктомия ввиду необратимых органных изменений.
Дренирование верхних мочевых путей при оперативном лечении больных гидронефрозом осуществляли с помощью катетера–стента или нефростомических дренажей в сочетании с пиелоуретеральным дренажом. Катетеры-стенты, как правило, удаляли через 9—12 суток после операции. У больных «поздним» гидронефрозом длительность дренирования верхних мочевых путей составила от 15 до 60 суток. Дренирование ЧЛС не применяли у 6-ти пациентов: у 3-х после уретеролизиса, у 2-х после резекции правой яичниковой вены и у одного – после резекции нижнесегментарных сосудов. Бездренажных реконструктивных операций не выполняли.
На начальной стадии гидронефроза, когда превалируют функциональные признаки стеноза ЛМС при сохранной или незначительно нарушенной функции почки, проводили консервативное лечение, направленное на предотвращение прогрессирования сужения, улучшение состояния верхних мочевых путей и восстановление уродинамики (n=62). Применяли вазоактивные препараты, спазмолитики и активаторы клеточных протеаз. У больных поздними стадиями заболевания после предварительного дренирования верхних мочевых путей и получения информации об обратимости структурно-функциональных изменений почки (n=14), применяли стимулятор стволовых клеток костного мозга - ленограстим (Граноцит).
Результаты исследования. Диагностика гидронефроза.
У обследованных 765 больных стенозом ЛМС, гидронефрозом боль явилась самым частым и ранним симптомом, наблюдавшимся у 566 (74%) пациентов. Характер боли менялся в зависимости от стадии заболевания, то есть от степени нарушения уро- и гемодинамики. Периодически возникающая тяжесть, чувство инородного тела в соответствующей половине живота или поясничной области у большей части больных трансформировалось в постоянную боль, усиливающуюся при обильном питье и физической нагрузке. Боль могла принимать характер почечных колик. Присоединение лихорадки и озноба наблюдалось у 45 (5,8%) больных, что свидетельствовало о присоединении воспалительного компонента. Гематурию наблюдали у 84 больных (11%); из них в 74 наблюдениях – микроскопическую. Увеличенную, напряженную почку пальпировали в 54 (7%) наблюдениях, что, как правило, соответствовало гигантскому гидронефрозу у больных поздними стадиями заболевания. Бессимптомное течение стеноза ЛМС, гидронефроза зафиксировали у 61 (8%) больного. Диагноз устанавливали на основании ультразвуковых или рентгеновских исследований, проводимых по иным (неурологическим) причинам.
Таким образом, данные клинического обследования позволяют лишь заподозрить гидронефроз, тогда как дифференциальный и уточняющий этап диагностики, отражающий изменения почечной паренхимы и верхних мочевых путей, возможен только на основании комплекса клинических и морфологических исследований.
Структурно-функциональное состояние верхних мочевых путей и почечной паренхимы у больных различными стадиями гидронефроза представлено в таблице 5.
Таблица 5. Структурно-функциональное состояние почечной паренхимы у больных начальной и ранней стадиями стеноза ЛМС, гидронефроза
|
Стадии заболевания |
Методы исследования |
|||
|
УЗИ (толщина почечной паренхимы, мм) |
Эходопплеро графия (индекс резистентности дугообразных артерий) |
МСКТ (толщина почечной паренхимы, мм) |
Динамическая нефросцинти графия (ДПФ, %) |
|
|
Начальная |
22±3,6 (21,2) |
0,52±0,05 (0,54) |
20±3,3 (20,9) |
43 - 53 (46,5) |
|
Ранняя |
17±5,1 (18,0) |
0,60±0,08 (0,56) |
18±4,2 (17,6) |
35 – 48 (43) |
Как следует из таблицы, средние величины толщины почечной паренхимы существенно не отличаются от нормальных как при начальном, так и раннем гидронефрозе. Результаты нефросцинтиграфии, сосудистой и паренхиматозной фаз МСКТ и эходопплерографии свидетельствуют о сохранной органной почечной микроциркуляции. Иначе говоря, структурно-функциональное состояние почечной паренхимы в начальной и ранней стадиях заболевания существенно не изменяется. Результаты инструментальных клинических методов исследования мы сравнили с результатами патогистологических исследований. В биоптатах почек у больных ранним гидронефрозом в подавляющем большинстве наблюдений установлена 1-я степень гидронефротических изменений. Нефрогидроз, как правило, носил очаговый характер. Количество почечных клубочков с признаками гиалиноза не превышало 25%. При иммуноморфологическом исследовании уровень экспрессии маркеров стромы и микроциркуляторного русла существенно не отличался от такового в контрольных биоптатах почечной ткани, а уровень экспрессии VEGF в большинстве наблюдений был повышен (табл. 10). Последнее свидетельствует в пользу развития процесса компенсации, направленного на сохранение адекватного кровоснабжения паренхиматозных структур, чувствительных к гипоксии. Наиболее вероятно саморегулирующаяся система поддержания гомеостаза, включающая в себя продуцентов VEGF – клеток канальцевого эпителия, и «эффекторного звена» – перитубулярных капилляров, обеспечивает кровоснабжение нефротелия.
Результаты проведенного анализа степени изменений чашечно-лоханочной системы у больных начальной и ранней стадиями гидронефроза представлены в таблице 6.
Таблица 6. Степень дилатации ЧЛС у больных стенозом ЛМС, гидронефрозом (УЗИ)
|
Стадия гидронефроза |
Степень дилатации ЧЛС (см) |
|
|
Лоханка |
Чашечки |
|
|
1-ая (начальная) |
1,0 – 2,6 (1,4)* |
Не определяется |
|
2-ая (ранняя) |
1,5 – 5,1 (2,8)* |
0,7 – 1,9 (1,3)* |
Примечание: * в скобках указаны средние значения
Изменения чашечно-лоханочной системы у данной категории больных за редким исключением носили незначительный характер и характеризовались либо пиелоэктазией либо (у больных ранней стадией заболевания) умеренной пиелокаликоэктазией. Полученные данные сопоставимы с результатами морфометрии верхних мочевых путей - общая толщина стенки лоханки составила 675±41,2 мкм, толщина мышечного слоя - от 52,6 до 54,3% (норма ≥ 62%). СМК составил в среднем 0,88.
Таким образом, у больных начальной и ранней стадиями гидронефроза для решения вопроса о выборе метода лечения необходима информация о структурно-функциональном состоянии верхних мочевых путей и ангиоархитектоники почки. Данные о функциональном состоянии почек, полученные путем, применения радионуклидных методик на этих стадиях заболевания, как правило, не влияют на выбор лечебной тактики. Для выявления сосудистых аномалий предпочтительнее МСКТ или МР-ангиография. Клиническая эффективность указанных методов исследования колеблется от 95 до 100%. Чувствительность и специфичность эходопплерографии при выявлении уровазального конфликта составила 72 и 85% соответственно.
Данные о структурно-функциональном состоянии почечной паренхимы и верхних мочевых путей у больных поздними (терминальная А и Б) стадиями заболевания представлены в таблице 7.
Таблица 7. Структурно-функциональное состояние почечной паренхимы и степень дилатации ЧЛС у больных «поздним» гидронефрозом до дренирования ЧЛС (n=25)
|
Стадия гидронефроза |
Методы исследования |
|||||
|
УЗИ |
Эходопп лерография (RI*) |
МСКТ * * (мм) |
Дин. нефро сцинтигр. (ДПФ, %) |
|||
|
Толщина паренхимы(мм) |
Лоханка * * * (см) |
Чашечки (см) |
||||
|
Терминальная А или Б |
7,9±2,7 |
4,1 – 14,0 (8,54) |
1,5 – 7,0 (3,28) |
0,69±0,05 |
7,3±4,7 |
8 – 25 |
* RI –указан индекс резистентности дугообразных артерий
** - указана толщина почечной паренхимы
* * * - указан поперечный размер лоханки
Как следует из таблицы, структурно-функциональное состояние почечной паренхимы у больных поздними (терминальная А и Б) стадиями гидронефроза значительно, порой необратимо, изменено.
Изменения верхних мочевых путей при поздних стадиях гидронефроза чаще всего также значительны и заключаются в «гипердилатации» ЧЛС с выраженным снижением сократительной способности и тонуса лоханки и чашечек. При морфометрии общая толщина стенки лоханок составила 579,1±48,6 мкм, толщина мышечного слоя — 165,9±18,1 мкм, т.е. 28,5% от общей толщины стенки; СМК превысил 1,5. При подобных изменениях верхних мочевых путей, при проведении органосохраняющих операциях, как правило, требуется удаление афункциональной части лоханки путем ее расширенной резекции. Кроме того, становится объяснимой при недостаточном объеме резекции лоханки остаточная дилатация ЧЛС у ряда больных и после адекватно сформированного, хорошо проходимого пиелоуретероанастомоза.
При не восстановленном оттоке мочи оценка структурно-функционального состояния почечной паренхимы у больных «поздним» гидронефрозом реально не отражает степени возникших изменений. Состояние почечной паренхимы у больных терминальными А и Б стадиями заболевания через 7 -10 суток после дренирования ЧЛС представлено в табл. 8 и 9.
Таблица 8. Структурно-функциональное состояние почечной паренхимы у больных терминальной А стадией гидронефроза (после дренирования ЧЛС) (n=17)
|
Стадия гидронефроза |
Методы исследования |
|||
|
УЗИ (толщина почечной паренхимы, мм) |
Эходопплерография ( RI дугообразных артерий) |
МСКТ (толщина почечной паренхимы, мм) |
Динамическая нефросцинтиграфия (ДПФ, %) |
|
|
Терминальная А |
5 – 18 (12)* |
0,46 - 0,67 (0,57)* |
4 – 17 (13)* |
18-46 (32,4)* |
*- в скобках указаны средние величины
Как следует из таблицы, у 17-ти (68%) больных терминальной А стадией гидронефроза структурно-функциональное состояние почечной паренхимы после дренирования ЧЛС существенно улучшилось: толщина почечной паренхимы в среднем составила 12 мм, на полюсах почек, как правило, была сравнима с контрлатеральной почкой; индекс резистентности достоверно снизился и составил в среднем 0,59; ДПФ увеличилась, составив в среднем 32,4%. Полученные результаты свидетельствуют об обратимости произошедших изменений и позволили выполнить реконструктивные операции на верхних мочевых путях. Правомочность выбранной тактики была подтверждена гистологическим и иммуноморфологическим исследованиями почечной паренхимы: выявленные отклонения относились ко второй степени морфологических изменений при обструктивной уропатии. Обращали на себя внимание признаки, характеризующие начало структурной перестройки сосудистого русла – стенка артерий среднего и мелкого калибра утолщалась за счет склероза, одновременно отмечались начальные признаки деградации артериол.
При иммуноморфологическом исследовании почечной ткани у этих больных экспрессия маркеров микроциркуляторного русла снижалась, экспрессия маркеров реорганизации стромы повышалась. Регистрация пониженного уровня экспрессии VEGF эпителием почечных канальцев оставалась доступной, что также свидетельствовало о потенциальной обратимости дистрофических изменений нефротелия (табл. 10). Таким образом, данные комплексного клинического и морфологического исследований позволяют утверждать, что терминальная 3А стадия заболевания, по существу таковой не является, а возникшие изменения в значительной степени обратимы. Обратная трансформация, казалось бы, необратимых изменений почечной паренхимы на фоне дренирования верхних мочевых путей позволила у больных терминальной А стадией гидронефроза сохранить почку, выполнив реконструктивную операцию.
Иная ситуация имела место у больных терминальной Б стадией заболевания (n=8) У 8-ми больных (32%) структурно-функциональное состояние почечной паренхимы после дренирования ЧЛС существенно не изменилось (табл. 9).
Таблица 9. Структурно-функциональное состояние почечной паренхимы у больных терминальной Б стадией гидронефроза после дренирования верхних мочевых путей (n = 8)
|
Стадия гидронефроза |
Методы исследования |
|||
|
УЗИ (толщина почечной паренхимы, мм) |
Эходопплерография (RI, дугообразных артерий) |
МСКТ (толщина почечной паренхимы, мм) |
Динамическая нефросцинтиграфия (ДПФ, %) |
|
|
Терминальная Б |
<5 |
>0,7 или кровоток не опр. |
<5 |
Кривая афункционального типа или изолиния |
Как следует из таблицы, толщина почечной паренхимы осталась прежней, кровоток либо по-прежнему не регистрировался, либо индекс резистентности почечных сосудов оставался выше 0,7, что свидетельствовало о редукции микроциркуляторного русла; ДПФ не определялась. В связи с наступлением необратимых атрофических изменений почечной ткани больным были выполнены органоуносящие пособия.
Изменения в почке у больных терминальной Б стадией гидронефроза характеризовались 3-й необратимой степенью морфологических изменений - соотношение между площадью интерстициального фиброза и сохранной паренхимой было не менее ½ (50 – 75%), а в отдельных случаях площадь склерозированной ткани превышала 90% площади биоптата.
При иммуноморфологическом исследовании экспрессия маркеров микроциркуляторного русла практически отсутствовала из-за деградации последнего. Основным паттерном экспрессии α-SMA до (+++) в большинстве случаев являлись α-SMA-позитивные клетки стромы, и, в первую очередь, миофибробласты, диффузно распределенные в значительно увеличенной в объеме строме органа. Отмечена крайне высокая экспрессия виментина. Экспрессия VEGF в эпителии канальцев отсутствовала (–) (табл. 10). Минимально выраженное иммунное окрашивание наблюдалось в эндотелии крупных сосудов артериального типа, что позволяет предположить возможность аутокринной регуляции процессов ангиогенеза в почке при терминальных гидронефротических изменениях и, соответственно, невозможность продукции факторов роста паренхиматозными клетками.
Таблица 10. Экспрессия α-SMA, виментина, CD34 и VEGF при гидронефрозе 1-й (ранняя стадия), 2-й (терминальная А стадия), 3-й (терминальная Б стадия) степени морфологических изменений и в ткани почки без гидронефротических изменений.
|
Иммуногисто химические маркеры |
Контрольная группа |
Гидронефроз 1-й степени (ранний) |
Гидронефроз 2-й степени (терминальный А) |
Гидронефроз 3-й ст. (терминаль ный Б) |
|
α-SMA |
++ (сосуды) / + (ПТГМК) |
+ (ПТГМК) / ++ |
+ / ++ (МФБ) |
++ /+++ (МФБ) |
|
Виментин |
+ (интерстиций) |
+ |
+ / ++ |
+++ |
|
CD34 |
++ / +++ (ПТК, клубочки) |
+++ |
++ |
-/+ / - |
|
VEGF |
(+) / ++ (нефротелий) |
++ |
+ / -/+ |
- / (-/+) |
Примечания. Критерии оценки: « - » – реакция отсутствует, « -/+ » - минимально выраженная положительная реакция, « + », « ++ », « +++ » - степени выраженности положительной реакции. Сокращения: ПТГМК – перитубулярные гладкомышечные клетки; МФБ – миофибробласты; ПТК – перитубулярные капилляры.
Таким образом, гистологические и иммуноморфологические исследования у этих больных полностью подтвердили данные клинических методов диагностики.
Полученные данные свидетельствовали, что терминальная 3Б стадия гидронефроза истинно необратима, а органоуносящая тактика у этой категории больных обоснована.
Программа обследования у больных гидронефрозом должна следовать принципу - коротким путем к наиболее полной и диагностически значимой информации. Инструментальное обследование с целью выявления обструктивной уропатии необходимо начинать с ультразвуковых методов диагностики - УЗИ, ФУЗИ, эходопплерография. После проведения УЗИ для уточнения диагноза целесообразно выполнение МСКТ с трехмерной, мультипланарной реконструкцией изображения и виртуальной уретеропиелокаликоскопией. При наличии противопоказаний к МСКТ возможно выполнение МР-уро- и ангиографии. Вместе с тем, при начальной или ранней стадиях неосложненного гидронефроза опытному хирургу, зачастую, достаточно информации, полученной при УЗИ и экскреторной урографии.
Инвазивные методы (комплексное сосудистое исследование почек, восходящая уретеропиелография, цистоскопия, оптическая уретеропиелоскопия и эндолюминальное УЗИ) должны выполняться по индивидуально обоснованным показаниям, в том числе при сопутствующих заболеваниях, аномалиях развития мочевых путей и почек, невозможности выполнения МСКТ или при послеоперационных осложнениях. Оптическая уретеропиелоскопия – метод выбора при подозрении на стеноз уретеропиелоанастомоза после реконструктивной операции по поводу гидронефроза.
Использование разработанного и модифицированного на базе ММА им. И.М. Сеченова комплекса неинвазивных лучевых методов диагностики позволило сократить количество инвазивных и эндоскопических диагностических исследований (цистоскопия, ретроградная, антеградная уретерография, оптическая уретеропиелоскопия и т.д.) на 34,8%; уменьшить частоту инфицирования мочевых путей и ятрогенных осложнений в 2,06 раза; уменьшить койко-день в 1,48 раза; практически отказаться от применения традиционной ангиографии, количество осложнений при которой составило более 7%, а смертность - 0,04%.
Гидронефроз. Современные технологии в лечении. Оперативное лечение.
Реконструктивные операции на лоханке и мочеточника должны выполняться с соблюдением требований пластической прецизионной хирургии:
- доступ - экстраплевральная торакотомия – прецизионный разрез длиной, как правило, 5-7 см;
- применение микроскопа или лупы с возможным увеличением в 2,5 - 4 раза особенно на этапе формирования уретеропиелоанастомоза;
- обязательное иссечение рубцово-измененных афункциональных тканей;
- формирование анастомоза без натяжения, чтобы избежать нарушений микроциркуляции и образования грубого рубца. Целесообразно использовать атравматические колющие или колюще-режущие иглы размером 1\2 – 16 мм или 3\8 – 20 мм;
- формирование анастомоза без «избытка» верхних мочевых путей; несоблюдение этого приводит к возникновению перегибов мочеточника с нарушением уродинамики сразу же после удаления дренажа-интубатора или катетера-стента;
- аккуратное, высокоточное отношением к тканям, применение только специальных микрохирургических инструментов, рассасывающегося шовного материала (викрил 4/0 - 5/0).
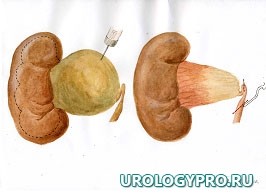
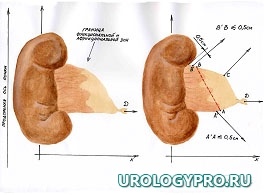
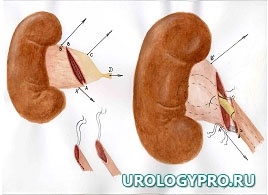
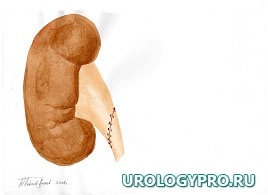
Каждая реконструктивная операция при гидронефрозе имеет свои особенности в зависимости от степени расширения и сократительной способности лоханки. С увеличением степени дилатации ЧЛС увеличивается степень морфологических изменений мочевых путей. Вместе с тем не вся стенка лоханки претерпевает одинаковые изменения. Ближе к почке за счет особенностей кровоснабжения степень изменений уменьшается. Это позволяет осуществить резекцию лоханки в пределах здоровых тканей. Нами предложена при гидронефрозе модель интраоперационного ориентирования с математических позиций, как ориентировочной основы действий для тех, кто начинает осваивать данное направление оперативной урологии. Это позволяет после опорожнения ЧЛС избежать отрицательно влияющей на результаты реконструктивной операции избыточной или недостаточной резекции лоханки, сохранить важные в функциональном отношении ее участки, добиться правильного с топографических позиций, места формирования уретеропиелоанастомоза. Представлена последовательность операционных действий как при больших атоничных (рис. 1), так и при смешанных, способных к сокращению лоханках, не требующих значительной резекции (рис. 2).
Рис. 1. Последовательность операционных действий при стенозе ЛМС, выраженном гидронефрозе (большая, атоничная, лоханка). Модель интраоперационного ориентирования с математических позиций.
А.
Б.
В.
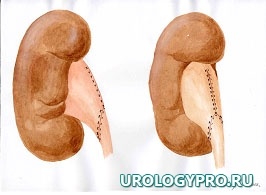
Г.
А. Пункция лоханки, отсечение мочеточника; Б. Установление границ функциональной и афункциональной зон лоханки. Определение границ резекции лоханки; В. Этап резекции лоханки. Установление катетера-стента в верхние мочевые пути; Г. Сформированный уретеропиелоанастомоз
Примечание – стрелками указаны направления тракции лигатур-держалок.
Рис. 2. Последовательность операционных действий при стенозе ЛМС, гидронефрозе (небольшая или смешанная, способная к сокращению, лоханка). Модель интраоперационного ориентирования с математических позиций.
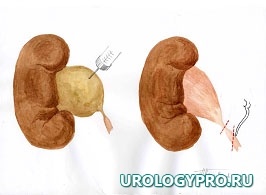
А.
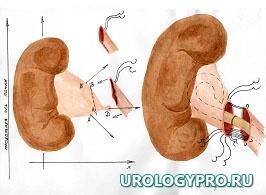
Б.
В.
А. Пункция лоханки, отсечение мочеточника; Б. Этап резекции лоханки. Установление катетера-стента в верхние мочевые пути; В. Сформированный уретеропиелоанастомоз.
Примечание – стрелками указаны направления тракции лигатур-держалок.
Из 607 операций, проведенных в клинике по поводу стеноза ЛМС, гидронефроза, осложнения имели место у 44 больных.
Таблица 11. Осложнения после открытых* операций (n=607), выполненных по поводу стеноза ЛМС, гидронефроза.
|
Вид осложнений |
Всего |
|
Кровотечение из почки |
5 |
|
Острый пиелонефрит, стеноз пиелоуретероанастомоза |
23 |
|
Несостоятельность анастомоза (мочевой затек) |
3 |
|
Забрюшинная гематома |
3 |
|
Нагноение раны |
3 |
|
Паранефральный абсцесс |
1 |
|
Стеноз пиелоуретероанастомоза |
6 |
|
Итого |
44 |
* реконструктивные и органоуносящие
Осложнения возникали чаще всего у больных с признаками воспалительного процесса в почках и мочевых путях. Практически все осложнения относятся к периоду с 1980 по 1990 гг.
Наиболее частым осложнением являлось развитие острого пиелонефрита и стеноза пиелоуретероанастомоза. Следует отметить, что подобное осложнение практически не встречалось после отказа от нефростомии как основного вида дренирования верхних мочевых путей после реконструктивных операций по поводу гидронефроза. Один больной умер по причине сердечно-легочной недостаточности.
Отдаленные результаты лечения больных стенозом ЛМС, гидронефрозом оценивали как хорошие, удовлетворительные и неудовлетворительные. Результаты считали хорошими, если наступало излечение от основного заболевания и его осложнений при улучшении функционального состояния почечной паренхимы и верхних мочевых путей. За последние 10 лет доля хороших результатов составила 92,9 %. Результаты считали удовлетворительными (4,7% оперированных больных за последние 10 лет), когда отмечалось улучшение структурно-функционального состояния почки и верхних мочевых путей, однако, окончательной нормализации не наступало и (или) могли оставаться отдельные жалобы. Неудовлетворительные результаты лечения за последние 10 лет зафиксировали лишь у 2,4% пациентов. У этих больных операция не сопровождалась улучшением состояния, требовались повторные хирургические пособия, которые также были неэффективны.
Из 9–ти эндоскопических операций 4 были выполнены ввиду стеноза уретеропиелоанастомоза после первичной реконструктивной операции. Лишь 5 операций (4 инвагинационных эндопиелотомии и одно перкутанное бужирование ЛМС) осуществлены по поводу первичного стеноза ЛМС. Лишь в одном наблюдении возникли осложнения в виде кровотечения на 3 сутки после перкутанной эндопиелотомии с развитием тампонады ЧЛС, повреждением париетальной плевры и развитием пневмогидроторакса. Отдаленные результаты прослежены у 7 пациентов. Получен удовлетворительный клинический эффект (исчезновение боли, снижение цифр артериального давления, нормализация анализа мочи). Адекватное восстановление уродинамики отмечено у 5-ти пациентов. Судьбу двух больных проследить не удалось.
Гидронефроз. Современные технологии в лечении. Консервативное лечение.
У 62 больных в начальной стадии гидронефроза, когда преобладают функциональные нарушения со стороны ЧЛС при отсутствии значимых органических изменений верхних мочевых путей (в первую очередь – гидрокаликоза) и почечной паренхимы мы проводили консервативное лечение. Применяли вазоактивные препараты, спазмолитики и активаторы клеточных протеаз. Улучшение функционального состояния ЧЛС и мочеточника достигнуто у 54 больных (87 %). У 8 больных ожидаемый эффект достигнут не был и консервативное лечение явилось подготовкой к реконструктивной операции.
При поздних стадиях гидронефроза после предварительного дренирования верхних мочевых путей, повторного обследования и получения информации об обратном развитии структурно-функциональных изменений почечной ткани, в комплексной терапии применяли стимулятор стволовых клеток костного мозга - ленограстим (Граноцит).
Таблица 12. Структурно-функциональное состояние почечной паренхимы и верхних мочевых путей у больных терминальной А стадией гидронефроза до дренирования, через 7 суток после дренирования ЧЛС и через 30 - 60 суток после введения граноцита (n=14)
|
УЗИ, МСКТ (см) |
RI паренхимы |
ДПФ % |
Плотность упаковки клубочков |
|||
|
Паренхима |
Лоханка |
Чашечки |
||||
|
До |
0,1—0,7 0,47* |
4,1-14,0 8,54* |
1,5 – 7,0 4,68* |
0,56 - 0,7 0,65* |
8-25 20,2* |
0,017 - 0,032 0,025* |
|
Через 7 суток |
0,5 – 1,8 1,2* |
Не опред. |
Не опред. |
0,46 – 0,67 0,57* |
18 – 46 32,4* |
0,031 - 0,047 0,041* |
|
Через 30-60 суток |
0,7 – 2,2 1,4* |
Не опред. |
Не опред. |
0,47 – 0, 64 0,55* |
18 – 44,5 33* |
0,031 - 0,047 0,043* |
Примечание * - средние значения; у 5 больных исходно кровоток в паренхиме не определялся.
Полученные данные свидетельствуют о положительной динамике В представленной таблице отражена положительная динамика структурно-функционального состояния почечной паренхимы после дренирования верхних мочевых путей и применения граноцита у больных терминальной А стадией щаболевания.
Таблица 13. Структурно-функциональное состояние почечной паренхимы и ЧЛС через 3 мес. после реконструктивной операции в подгруппе больных терминальной А стадией гидронефроза, получавших Граноцит (n=14) и в контрольной (n=5)
|
|
УЗИ, МСКТ (см) |
RI парен химы |
ДПФ, % |
||
|
Паренхима |
Лоханка |
Чашечки |
|||
|
1-ая подгруппа (Граноцит) |
0,7 – 2,2 1,4* |
0-6,5 2,7* |
0 – 1,0 0,8* |
0,46 – 0,65 0,58* |
34–46 39* |
|
2-ая подгруппа (контроль) |
0,5 – 2,0 1,2* |
0-7,1 2,9* |
0,2 – 1,8 1,3* |
0,56 – 0,65 0,62* |
28–39 36* |
|
Значение р |
0,20 |
0,10 |
0,06 |
0,05 |
0,10 |
Примечание * - средние значения
Как видно из таблицы, в подгруппе больных, получавших лечение граноцитом, степень положительных изменений почечной ткани была больше, хотя различия не достигли уровня статистической значимости, прежде всего в связи с небольшим размером групп сравнения.
Таким образом, комплексное лечение больных поздними стадиями гидронефроза предполагает дренирование верхних мочевых путей, медикаментозную активизацию кровотока и регенерацию почечной ткани. Для этого в комплексную терапию у больных терминальной А стадией заболевания возможно включение стимулятора стволовых клеток костного мозга – граноцита.
Следует отметить, что традиционное медикаментозное и хирургическое лечение направлено на устранение причины заболевания и реабилитацию сохранных клеток, в то время как клеточная терапия преследует своей целью восстановление или замещение выбывших из строя дефектных, погибших клеток. Отсюда следует, что для получения максимального эффекта от проводимого лечения клеточная терапия должна сочетаться с медикаментозными и хирургическими методами лечения.
Изложенные в нашей работе и широко применяющиеся на протяжении многих лет в клинике принципы и положения позволили при лечении больных стенозом ЛМС, гидронефрозом:
- снизить количество осложнений до 1,1%;
- увеличить количество органосохраняющих пособий при поздних стадиях заболевания до 68%;
- добиться хорошего функционального результата реконструктивных операций в 92,9 %.
Все вышеперечисленное стало возможным в результате нового уровня интеграции усилий клиницистов, морфологов и специалистов лучевой диагностики. Мы надеемся, что полученные результаты дадут врачам возможность с успехом использовать в своей деятельности накопленный нами опыт лечения больных гидронефрозом, что будет способствовать главной цели нашей работы – уменьшению числа осложнений и органоуносящих пособий при данном заболевании.
Выводы
1. Применение современных высокотехнологичных методов исследования (МСКТ, МРТ, виртуальная эндоскопия, эходопплерография, оптическая уретеропиелоскопия) и лечения (микрохирургическая техника, современный шовный материал, внутреннее дренирование верхних мочевых путей, клеточная терапия в поздних стадиях) больных стенозом ЛМС, гидронефрозом способствовало получению хорошего функционального результата реконструктивных операций - 92,9%.
2. Применение высокотехнологичных методик: МСКТ, МРТ, виртуальной эндоскопии, УЗИ, ФУЗИ, эходопплерографии, статической нефросцинтиграфии, морфометрии, иммуноморфологических исследований у больных стенозом ЛМС, гидронефрозом способствовало: а) сокращению инвазивных лучевых и эндоскопических методов исследования на 34,8%; б) уменьшению частоты инфицирования мочевых путей и ятрогенных осложнений в 2,06 раза; в) практически полному отказу от почечной ангиографии; г) уменьшению койко-дня в 1,48 раза.
3. У больных стенозом ЛМС, гидронефрозом выявлены органические изменения в зоне верхней трети мочеточника, ЛМС и стенки лоханки - толщина мышечного слоя составила от 28,5% до 54,3% от толщины стенки верхних мочевых путей (норма ≥ 62%); соединительно-тканный мышечный коэффициент составил в среднем 0, 88 у больных ранним гидронефрозом и превысил 1,5 у больных поздними стадиями гидронефроза, вследствие чего развивается механический или динамический компонент обструкции.
4. При раннем гидронефрозе экспрессия маркера сосудистого русла (CD34) находится на нормальном уровне, а экспрессия VEGF (маркера ангиогенеза) повышена, что является свидетельством компенсации.
Существенное повышение уровня экспрессии и изменение локализации иммунного окрашивания маркеров интерстиция установлено при переходе между 2-й и 3-й степенями выраженности гидронефротических изменений (клинически - терминальной А в терминальную Б стадии), при этом уровень экспрессии маркеров сосудистого русла и ангиогенеза резко снижен ввиду выраженной деградации микроциркуляторного русла перитубулярного пространства и атрофии паренхимы, что соответствовало терминальной Б стадии гидронефроза.
5. У больных терминальной А и Б стадиями гидронефроза с выраженными склеротическими изменениями верхних мочевых путей (СМК > 1,5) плотность упаковки клубочков составила 0,045 ± 0,020, морфологические изменения в паренхиме были представлены всеми степенями, а иммуноморфологическое исследование не выявило закономерностей в соотношении уровней экспрессии маркеров интерстиция и сосудистого русла. Установлено отсутствие прямой зависимости между выраженностью структурно-функциональных изменений в стенке верхних мочевых путей и почечной паренхиме.
6. У 68% больных «поздним» гидронефрозом результаты высокотехнологичных методов исследования после предварительного дренирования верхних мочевых путей свидетельствовали о терминальной А стадии заболевания. Результаты гистологического исследования после проведенных реконструктивных операций выявили 1-ую или 2-ую степень морфологических изменений. Таким образом, стадия гидронефроза 3А не является терминальной, а структурно-функциональные изменения почечной паренхимы у этой категории больных носят обратимый характер.
7. У 32% больных «поздним» гидронефрозом результаты высокотехнологичных методов исследования после предварительного дренирования верхних мочевых путей свидетельствовали о терминальной Б стадии заболевания. Результаты гистологического исследования после органоуносящих пособий выявили 3 степень морфологических изменений. Таким образом, стадия гидронефроза 3Б является истинно терминальной, а структурно-функциональные изменения почечной паренхимы носят необратимый характер.
8. В случае невозможности проведения дифференциального диагноза между терминальной А и Б стадиями гидронефроза требуется дренирование верхних мочевых путей с повторным функциональным обследованием через 7-10 суток. В терминальной Б стадии обратного развития структурно-функциональных изменений почечной паренхимы не происходит; в терминальной А стадии – изменения обратимы. Подобная тактика способствовала снижению количество органоуносящих пособий при терминальных стадиях заболевания до 32%.
9. Применение стимулятора стволовых клеток костного мозга (граноцита) в предоперационном периоде у больных терминальной А стадией гидронефроза на фоне дренирования верхних мочевых путей в сравнении с контрольной группой приводило к улучшению структурно-функционального состояния почечной паренхимы (толщина была больше на 14,3 %, индекс резистентности дугообразных артерий ниже на 6,5%, а ДПФ выше на 3%) и сопровождалось лучшими функциональными результатами реконструктивной операции.
10. Соблюдение принципов прецизионной хирургии, резекция лоханки в соответствии с ее структурно-анатомическими особенностями, правильное формирование уретеропиелоанастомоза, воздержание от операции в условиях острого пиелонефрита, использование современного синтетического рассасывающего шовного материала, применение внутреннего дренирования верхних мочевых путей у больных гидронефрозом сопровождается снижением количества осложнений до 1,1%.
11. Применение эндоскопических операций у больных стенозом уретеропиелоанастомоза приводит к уменьшению степени дилатации ЧЛС и не сопровождается серьезными осложнениями в отличие от повторных открытых реконструктивных операций, выполнение которых в 41 – 55 % заканчивается нефрэктомией.
Практические рекомендации
1. Оценку структурного состояния верхних мочевых путей и почек у больных начальными и ранними стадиями гидронефроза целесообразно осуществлять путем использования УЗИ и экскреторной урографии. При неинформативности экскреторной урографии показана МСКТ или МР-урография.
2. Оценку функционального состояния ЧЛС и почек у больных начальными и ранними стадиями гидронефроза целесообразно осуществлять путем использования ФУЗИ и эходопплерографии.
3. Для уточнения диагноза в отношении терминальной А и Б стадий гидронефроза показано дренирование ЧЛС путем нефростомии или установки катетера-стента. Оценка структурно-функционального состояния почечной паренхимы и ангиоархитектоники почки должна быть проведена не ранее 7-10 суток с момента дренирования.
4. Иммуноморфологический анализ (оценка экспрессии α-SMA, СD-34, виментина и VEGF) при реконструктивных операциях у больных «поздним» гидронефрозом может быть использован как прогностический критерий заболевания. Третья степень морфологических изменений, плотность упаковки клубочков < 0,2 отсутствие экспрессии α-SMA и СD-34 артериолами и перитубулярным пространством, а VEGF - нефротелием при высоком уровне виментина свидетельствуют о необратимой атрофии почечной паренхимы.
5. Объем резекции верхних мочевых путей при реконструктивных операциях по поводу стеноза ЛМС, гидронефроза должен определяться в зависимости от размеров афункциональной зоны верхней трети мочеточника и лоханки. Прогноз и сроки восстановительного периода у больных «гигантским» гидронефрозом возможен по результатам гистологического и морфометрического исследований стенки лоханки.
6. При сохранении клинических проявлений и дилатации ЧЛС, не соответствующей срокам реконструктивной операции целесообразно выполнение МСКТ с виртуальной уретеропиелоскопией. При подозрении на стеноз уретеропиелоанастомоза показано выполнение оптической уретеропиелоскопии.
7. Выполнение малоинвазивных эндоскопических пособий с целью восстановления уродинамики у больных стенозом уретеропиелоанастомоза целесообразно в ранние, после реконструктивной операции, сроки.
8. Применение стимулятора стволовых клеток костного мозга (граноцит) целесообразно в комплексном лечении больных терминальной А стадией гидронефроза с целью достижения максимально возможной регенерации почечной ткани.